약물감시란?

개발부터 시판 후까지 이상반응 감시
약물감시(Pharmacovigilance, PV)란 의약품 사용 중 발생하는 이상 사례나 안전성 관련 문제를 ▲탐지 ▲평가 ▲해석 ▲예방하는 과학적 연구 활동이다.
악물감시 체계는 1957년 입덧 치료제 ‘탈리도마이드(Thalidomide)’ 사건을 계기로 본격 구축됐다. 당시 충분한 임상시험을 거치지 않고 약물이 출시되면서 약 1만 명의 사지 결손 기형아가 태어난 사건은, 의약품의 안전성을 확보하는 것이 중요하다는 것을 알린 계기가 됐다.
약물감시는 의약품의 개발 초기 단계부터 임상시험, 시판 후까지 의약품 사용 전 주기에 거쳐 이루어진다. 임상시험 단계에서는 의약품 사용으로 인한 부작용이나 유해 사례를 조기에 발견해 환자의 안전을 확보한다. 시판 후 단계에서는 중대 위험을 예방하고 의약품을 개선 및 관리하는데 활용한다.
한국에서는 식품의약품안전처를 중심으로 약물 감시 체계를 운영하고 있다. 각 바이오 제약 기업도 PV부서를 만들어 자발적으로 약물 부작용 보고 및 감시활동을 하고 있다.

인과성 여부로 결과 분류
약물감시 결과는 ▲부작용 ▲이상 사례 ▲약물 이상반응으로 나뉜다.
‘부작용(Side Effect)’은 의약품을 정상적인 용량으로 투여한 뒤 의도하지 않게 발생한 모든 효과로, 예상하지 못한 긍정적인 효과도 포함된다. 임상시험 단계에서 확인된 부작용은 복약안내문에 적어 환자에게 알리도록 하고 있다.
‘이상 사례(Adverse Event)’는 임상시험용 의약품을 투여한 시험 대상자에게 의도하지 않게 부정적인 증후, 증상 또는 질병이 발생한 경우를 말한다. 임상시험용 의약품과 반드시 인과관계가 있는 것은 아니지만 안전성을 평가하기 위해 보고가 필요하다.
‘약물 이상반응(Adverse Drug Reaction)’은 임상시험용 의약품의 임의 용량을 투여했을 때 발생한 모든 유해하고 의도되지 않은 반응을 말한다. 특히 의약품과의 인과관계를 배제할 수 없는 경우를 말한다. 간혹 인과관계가 알려지지 않았지만 제약사가 자발적으로 보고한 이상 사례도 약물 이상반응으로 간주한다. 이후 보고자와 제조자∙의뢰자 모두가 의약품과 환자의 반응이 관련 없다고 판단한 경우에는 약물 이상반응에서 제외한다.
이상 사례 발견 시, 안전성 재검토
이상 사례와 약물 이상반응이 확인되는 경우 식품의약품안전처 산하 한국의약품안전관리원(Korea Institute of Drug Safety & Risk Management, KIDS)에 보고해야 한다.
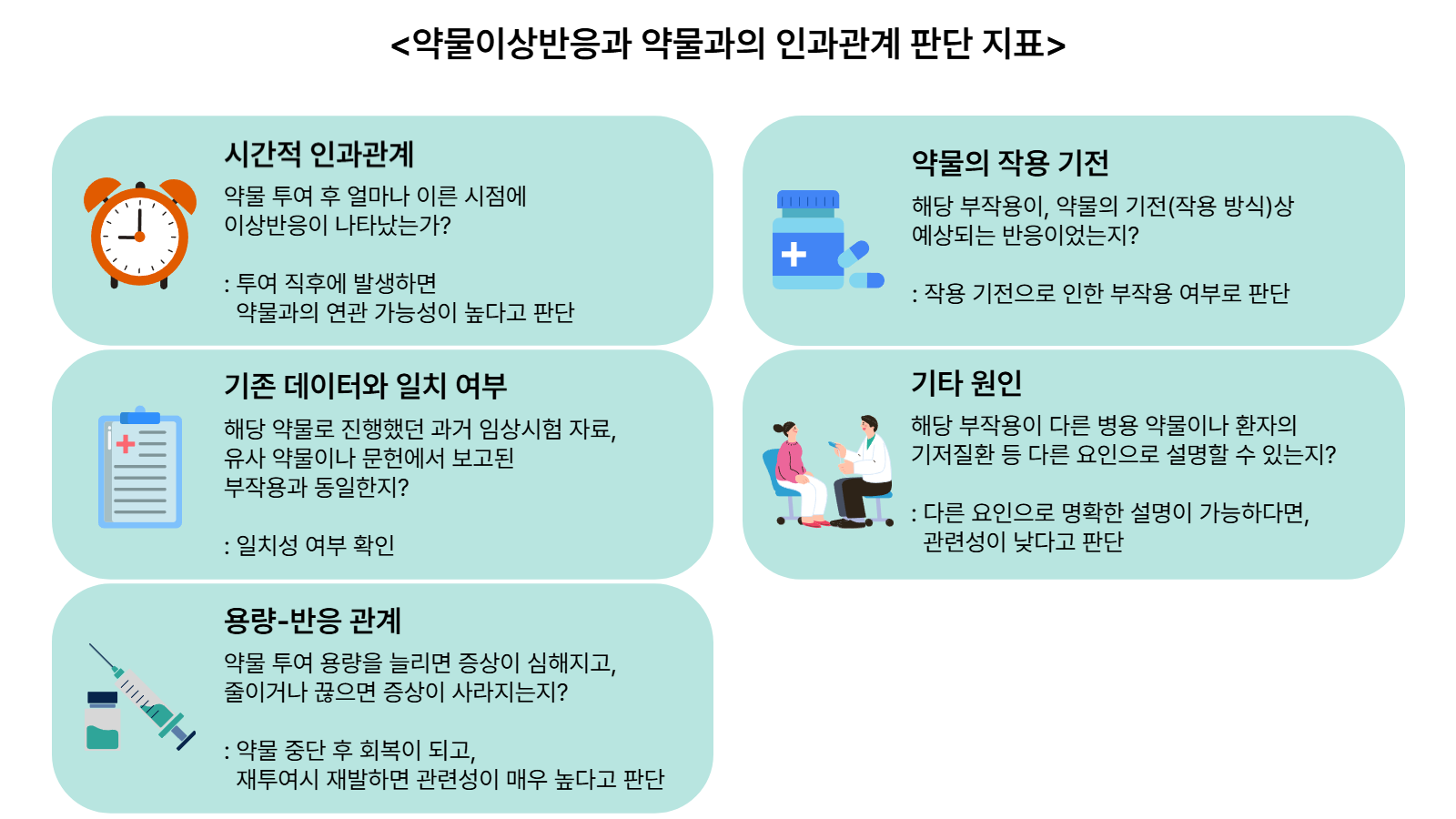
이후 기업과 임상시험 수탁기관(CRO)은 ▲시간적 인과관계 ▲기존데이터와의 일치 여부 ▲용량-반응 관계 ▲ 기타 원인 존재여부 ▲약물의 작용 기전을 기준으로 약물과 이상반응 연관성 여부를 재검토한다. 필요에 따라 독립적인 안전성평가위원회가 참여하기도 한다.
※ 참고자료
1. <의약품안전관리, 약물감시용어>, 한국의약품안전관리원
2. <PV(Pharmacovigilance, 약물감시)가 뭔가요?>, 생물학연구정보센터(Biological Research Information Center, BRIC)










