튼튼하게 지은 mRNA 전달체로
항암백신 개발 도전하는 차백신연구소
mRNA를 활용한 의약품이 각광 받고 있다. 타깃 바이러스의 유전체 정보만 알면 mRNA 백신∙치료제를 빠르게 설계, 생산할 수 있다. 글로벌 바이오기업들은 mRNA를 활용해 코로나19 백신을 시작으로 독감, RSV(호흡기세포융합바이러스)와 같은 감염질환 백신과 항암 백신 등을 연구 중이다.
mRNA는 메신저 리보핵산(messenger RNA)의 준말로, 단백질을 합성할 수 있는 DNA(유전정보)를 담아서 전달하는 전령(messenger) 역할을 수행한다. 1960년대 처음 발견된 이후 연구가 거듭되면서 2000년대 들어 학계의 본격적인 관심을 받기 시작했다. 지난해 mRNA 기술 개발의 주역인 카탈린 카리코(Katalin Karikó) 독일 바이오엔테크 수석 부사장과 드루 와이스먼(Drew Weissman) 미국 펜실베이니아대 의대 교수가 수상 노벨 생리의학상을 수상하기도 했다.
차백신연구소도 mRNA에 주목, 연구를 진행 중이다. 독자개발한 면역증강제를 사용한 mRNA 전달체를 개발 중이며, mRNA를 기반으로 한 항암 백신도 연구하고 있다.
mRNA 의약품, 세포 내부까지 안전하게 전달해줄 물질 필수
코로나19 팬데믹을 계기로 mRNA가 본격적으로 학계와 대중의 관심을 받기 시작했다. 백신을 제조하는 여러가지 방법 중 mRNA를 활용한 것이 가장 빠르게 백신을 개발, 사용할 수 있었기 때문이다.

<mRNA는 단백질을 합성할 수 있는 유전정보를 담아 전달하는 메신저 역할을 한다.>
mRNA의 가장 큰 장점은 이러한 신속성에 있다. mRNA는 특정 단백질을 만드는 ‘설계도’ 역할을 한다. 어떤 바이러스든 유전 정보만 알면 해당 바이러스에 대항할 수 있는 항체 단백질을 체내에서 만들 수 있다. 코로나뿐 아니라 독감, 암, 희귀질환 등의 다양한 백신과 치료제를 개발하는데 사용될 수 있다. mRNA는 정보를 전달하는 역할이 끝나면 일정 시간 후 파괴된다. 따라서 세포 속에 오래 잔류하면서 문제를 일으키는 일이 거의 없다.
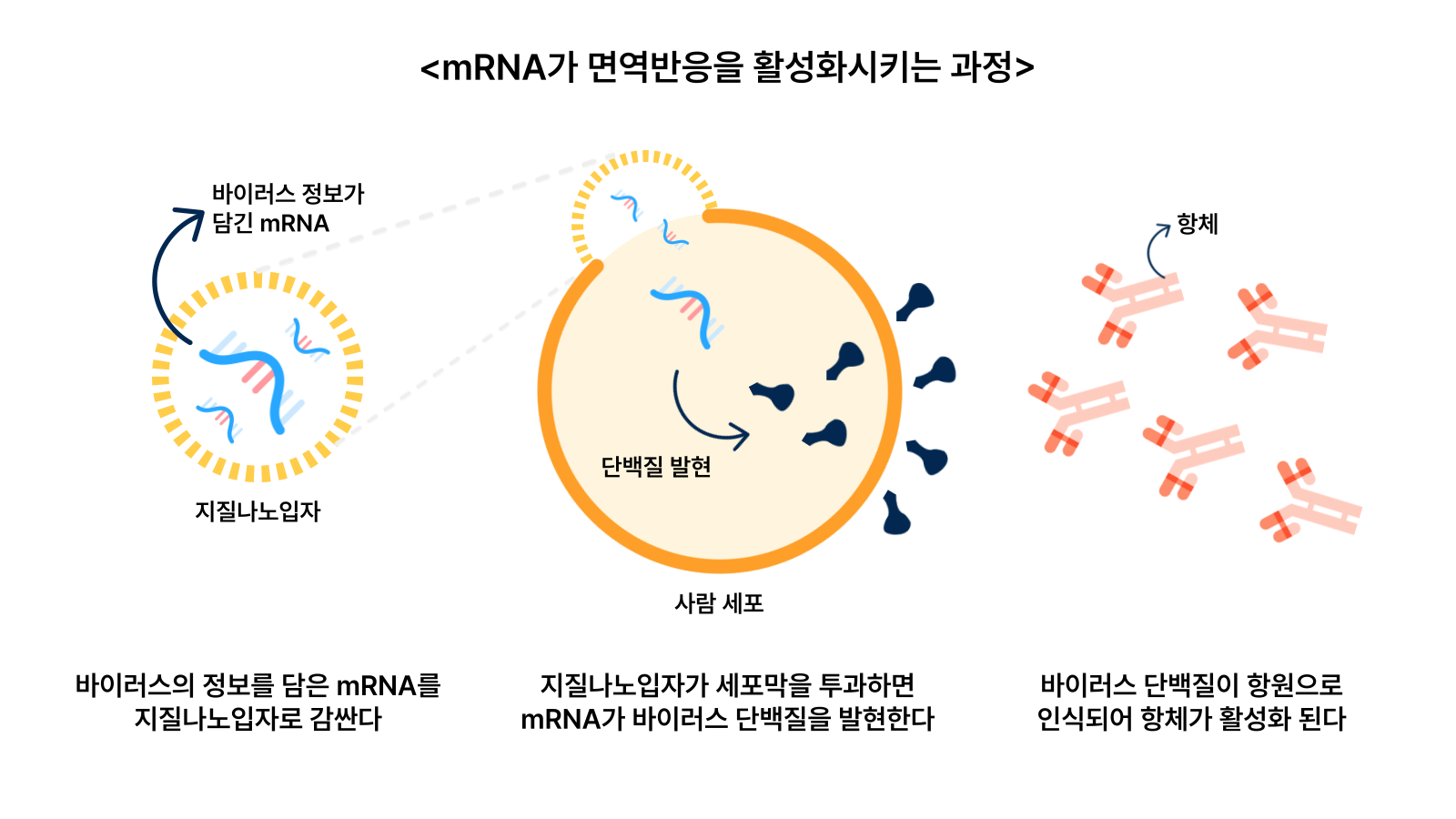
반면 단점도 명확하다. mRNA는 기본적으로 불안정하고 쉽게 분해된다. 영하 70도 이하의 초저온에서 보관되어야 한다. 유통과정에서 초저온 콜드체인을 갖춰야 하는 이유다. 또 우리 몸에는 RNA를 분해하는 효소가 있어, 체내에 주입하면 금방 분해된다. 그래서 mRNA를 체내에서 보호해줄 수 있는 보호막이 필요하다. 마지막으로 mRNA는 음이온이 과량 존재하기 때문에 지질 이중층으로 구성된 세포막을 통과해 세포 내부까지 진입하는 것이 쉽지 않아 세포 내부로 전달해주는 전달체가 필요하다.
LNP(지질나노입자), mRNA 전달해주지만 독성 등 한계 있어
이러한 mRNA의 단점을 극복하기 위해 개발된 물질이 LNP(Lipid Nano Particle, 지질나노입자)다. 지질나노입자는 mRNA를 생체에 주입했을 때 유도되는 선천성 면역반응과 불안정성을 극복하고, mRNA를 표적 조직과 세포로 안전하게 이동시켜주는 전달 시스템이다.
LNP는 간단하게 말하면 mRNA를 감싸는 지방 주머니다. 이 지방 주머니는 ▲mRNA의 음이온을 중화시킬 수 있는 이온화 양이온성 지질 ▲LNP의 지질 이중막 구조를 유지하고 세포막을 잘 투과할 수 있는 인지질과 콜레스테롤 ▲LNP의 체내 안정성을 높이는 폴리에틸렌글리콜(PEG, polyethylene glycol) 지질 성분 등 3가지 주요 성분으로 구성된다.
이온화 양이온성 지질은 LNP의 핵심 구성 성분으로, mRNA가 가진 음전하를 중화시켜 세포막 투과 효율을 높인다. 또 콜레스테롤과 인지질은 LNP의 구조적 안정성을 제공한다. PEG는 체내 면역 체계로부터 mRNA를 보호하고 순환이 더 길어지도록 한다. 결론적으로 LNP는 mRNA가 생체 내 효소 등에 의해 분해되지 않도록 보호하고 mRNA가 가진 음전하를 중화시켜 세포막 투과 효율을 높인다. 세포 내로 들어온 LNP는 mRNA와 분리되어 분해되고 mRNA는 세포질에서 단백질 발현 과정에 참여한다.
하지만 LNP는 열역학적으로 불안정한 구조여서, 초저온 상태를 유지해야만 유통이 가능하다. 또한 LNP의 지질이 간(肝)으로 우선적으로 전달되는 특성이 있는데, 이 때문에 간독성에 의한 부작용 우려가 있다. 상용화된 LNP는 PEG(Polyethylene glycol, 폴리에틸렌글라이콜) 성분을 사용하는데, 이 성분의 불안정성으로 아나필락시스 반응 등 과도한 알레르기 반응이 나타나기도 한다.
특허 문제도 있다. ‘앨나일람 파마슈티컬스(Alnylam Pharmaceuticals)’는 화이자와 모더나가 코로나19 백신을 개발할 때 자사의 LNP 관련 기술을 침해했다고 소송을 제기했다. ‘아뷰투스 바이오파마 (Arbutus Biopharma)’도 독일 바이오앤텍이 LNP 관련 특허를 침해했다고 소송을 건 바 있다. 현재도 소송이 진행 중이며, 몇몇 기업은 특허 문제를 피하기 위해 별개의 LNP 기술을 개발하고 있다.
리포플렉스, 간독성 없고 상온 보관 가능… LNP 단점 극복
차백신연구소는 이러한 LNP의 단점을 극복하기 위한 신규 mRNA 전달체 ‘리포플렉스(Lipoplex)’를 개발하고 있다. 리포플렉스는 리포좀(Liposome) 기반의 mRNA 전달체다. 리포좀을 구성하는 리피드(lipids) 제형을 최적화하고, 여기에 차백신연구소가 독자개발한 TLR2 기반의 면역증강제를 첨가했다. 그 결과 타깃항원의 발현 효율이 증가했고, mRNA도 더 효과적으로 전달했다.
리포플렉스는 LNP를 구성하는 PEG를 사용하지 않아 아나필락시스와 같은 알레르기 반응을 유발하지 않는다. 또 리포좀은 동결건조가 가능해 별도의 콜드체인을 구성할 필요 없이 상온에서 보관하고 유통할 수 있다.
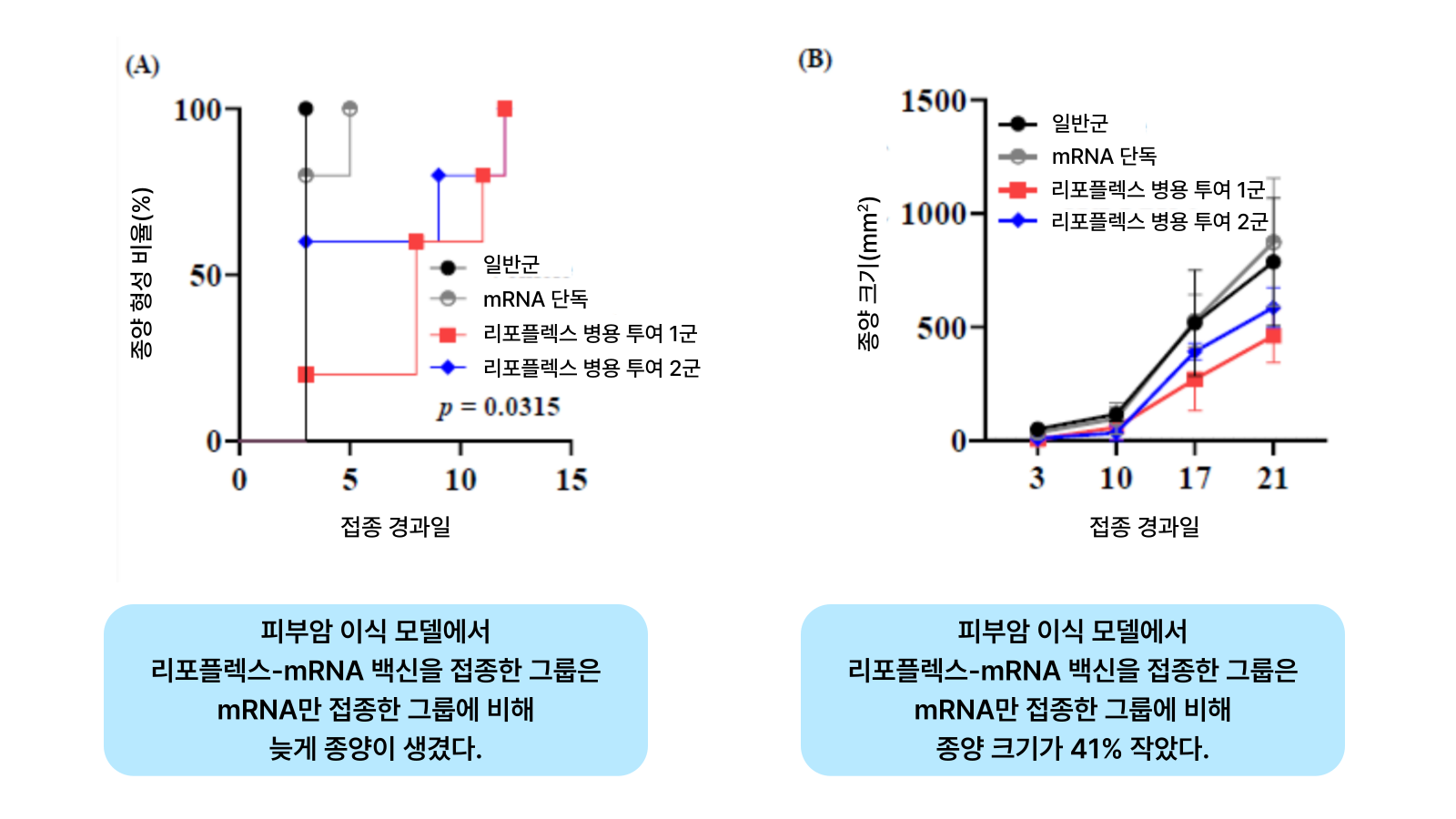
동물실험 결과에서도 리포플렉스가 mRNA를 효과적으로 전달하고, 면역 및 항암효과를 유도한 것을 확인했다. 차백신연구소는 피부암을 이식한 마우스 모델에 mRNA를 단독투여한 실험군과 mRNA-리포플렉스를 투여한 실험군을 비교했다. 그 결과 3일차부터 종양이 형성되기 시작한 mRNA 단독 투여 그룹에 비해 리포플렉스와 mRNA를 투여한 그룹은 8일차에 종양이 형성된 것을 확인했다. 21일차에 종양 크기를 비교했을 때도, 리포플렉스와 mRNA를 투여한 그룹이 그렇지 않은 그룹 대비 41% 작은 것으로 확인됐다.
또한 리포플렉스와 mRNA를 투여한 그룹에서 면역반응도 크게 증가했다. mRNA와 리포플렉스를 투여한 그룹은 대조군 대비 체액성 면역반응은 50배, 세포성 면역반응은 15배 증가했다. 면역반응이 증가했음에도 LNP 사용시 나타나는 간독성이나 다른 부작용은 없었다.
차백신연구소는 이러한 연구 결과를 지난해 독일 베를린에서 열린 ‘제 11회 국제 mRNA 헬스 컨퍼런스(International mRNA Health Conference)’에서 포스터를 발표했다. 해당 컨퍼런스에서 진행된 비즈니스 미팅에서 다수의 글로벌 기업이 리포플렉스를 활용한 백신∙치료제 공동개발 가능성을 확인했다. 차백신연구소는 리포플렉스의 안정성과 전달력, 면역증가 효능을 활용해 mRNA 기반의 항암백신을 개발할 계획이다. #










