탯줄 유래 줄기세포로 만성 허리 통증 잡는다

물건은 세월이 흐르면서 닳고 고장이 나기 마련이다. 사람의 몸도 비슷하다. 나이가 들면서 노화가 시작되면 척추나 그 주변 근육과 인대에 퇴행성 변화가 나타나며 이로 인해 다양한 척추 질환에 노출될 위험이 높아진다.
33개의 뼈로 구성된 척추는 중추신경 다발인 척수(脊髓)를 감싸서 보호한다. 척추뼈 사이에 있는 23개의 추간판(椎間板, Disk)은 척추의 운동과 충격을 완화해 주는 역할을 한다. 그런데 나이가 들면서 척추와 추간판도 퇴행한다. 척추나 추간판이 퇴행해 염증이 심해지면 허리 통증이 생기고 척추 질환으로 이어진다.
3개월 이상 지속되는 만성 요통, 근본적인 치료제 없어
‘퇴행성 디스크 질환(Disk Degeneration, DD)’은 척추 뼈 사이의 추간판이 돌출하거나 뼈마디의 네 귀퉁이에 ‘골극’이라고 불리는 가시 같이 뾰족한 뼈가 자라면서 주변 근육과 신경을 자극하게 됨에 따라 염증과 통증을 동반하는 질환이다. 퇴행성 질환이라 노화 과정에서 누구에게나 생긴다.
특히 3개월 이상 통증이 계속 될 경우 만성 요통으로 분류된다. 전체 척추 디스크 환자 중 10% 가량이 만성 요통 환자로 추정된다. 퇴행성 요추 추간판 탈출증으로 인한 만성요통은 비가역적 퇴행성 질환으로 심하면 보행 장애로 이어진다.
진통제 투약, 물리치료, 통증 차단술, 수술 등으로 통증을 관리하지만 근본적인 치료가 되지는 않는다. 또 수술의 경우 수술 후 합병증이 생길 수 있고, 재발률이 40%에 달해 새로운 치료제에 대한 수요가 크다.
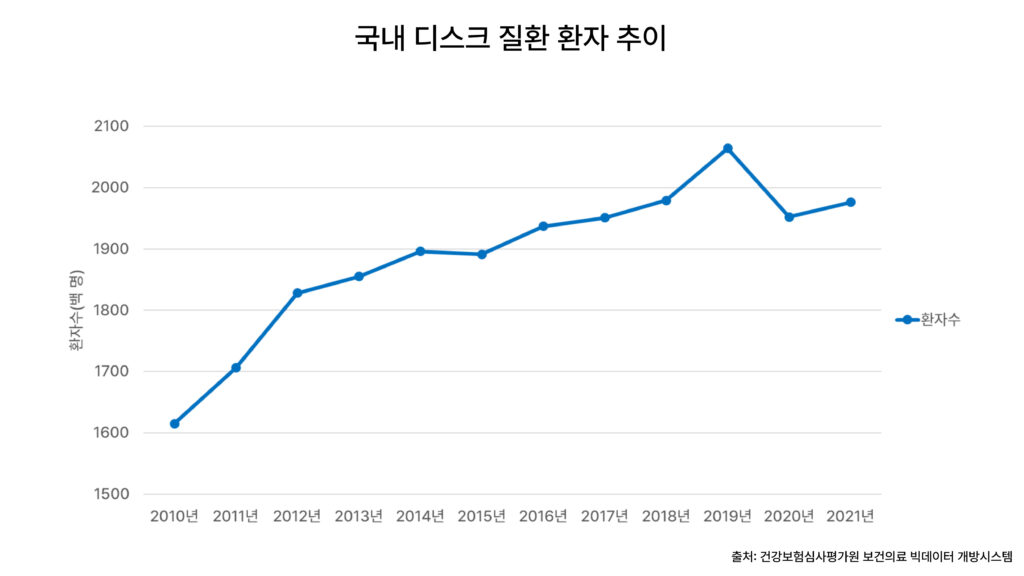
건강보험심사평가원 보건의료 빅데이터 개방시스템에 따르면 ‘디스크 질환(M51)’으로 병원에서 진료 받은 국내 환자가 2010년 165만명에서 2021년 198만명으로 꾸준히 증가하고 있다. 연령별로는 60대 환자가 가장 많고, 이중 여성이 62.3%를 차지한다. 디스크 질환으로 인한 요양급여비용총액은 2010년 4600억원에서 2021년 7860억원으로 증가했다.
<기타 추간판 장애(질병코드 M51) 환자 통계>
고순도 줄기세포 분리·배양 특허기술로 만성 요통 세포치료제 개발

차바이오텍 연구원이 CordSTEM-DD를 배양하고 있다.
차바이오텍은 탯줄 유래 줄기세포를 이용해 퇴행성 요추 추간판으로 인한 만성 요통 세포치료제 ‘CordSTEM-DD(코드스템-DD)’를 개발하고 있다.
차바이오텍은 ‘탯줄 유래 부착형 줄기세포, 그의 제조방법 및 용도’에 대해 국내뿐만 아니라 일본과, 유럽 특허를 보유하고 있다. 줄기세포치료제에 많이 사용되는 성인 골수 유래 줄기세포에 비해 면역조절 및 신경재생 등에 직접적으로 작용하는 주요 인자들이 높게 발현하는 탯줄 유래 줄기세포를 배양하는 기술이다.
이 특허기술을 활용하면 탯줄 조직에서 줄기세포를 분리할 때 발생할 수 있는 세포손상을 최소화할 수 있다. 또 사람의 인체 내부와 유사한 저산소 환경에서 배양하기 때문에 순도가 높은 세포를 더 많이 증식할 수 있어 세포의 제조 효율성을 높일 수 있다. 그래서 공여된 하나의 조직에서 수십만 명에게 투여 가능한 규모로 세포를 생산할 수 있다.
독자 개발한 동결기술로 상업화 경쟁력 갖춰

차바이오텍 연구원이 바이오탱크에 보관 중인 세포를 확인하고 있다.
차바이오텍은 자체 개발한 동결기술을 ‘CordSTEM-DD’에 적용했다. 차바이오텍이 독자 개발한 동결기술을 세포치료제 개발에 적용하면 얼리지 않은 세포치료제와 동일하게 기능할 수 있고, 사용할 수 있는 기간 또한 대폭 늘어난다. 또 치료제를 동결 보관했다가 의료진이 처방하는 즉시 해동해 환자에게 투여할 수 있는 ‘Ready to use’ 제품을 만들 수 있어 환자와 의료진의 불편을 줄였다.
‘CordSTEM-DD’는 소량 생산에 따른 고가의 치료비와 짧은 유효기간 등 비동결 제품의 한계를 뛰어넘어 상업화 경쟁력을 갖춘 치료제가 될 것으로 기대된다.
2023년 9월 1·2a상 최종 결과 발표 예정
퇴행성 요추 추간판으로 인한 만성 요통에 대한 근본적인 치료제가 없는 만큼 차바이오텍은 세포치료제 ‘CordSTEM-DD’의 임상 속도를 높이고 있다. 2016년 식약처로부터 임상 1/2a상 승인을 받았고, 2022년 4월 모든 대상자에게 투여를 완료했다. 2023 년 4월 식약처에 ‘ 임상시험종료보고서’를 제출했고, 9월말 1·2a상 최종 결과를 발표할 예정이다. 임상 시험 결과에 따라 다음 단계 임상시험을 계획해 식약처에 IND(임상시험계획서)를 제출하고, 국내 뿐만 아니라 다국가 임상을 통해 글로벌 진출을 추진할 계획이다. #