[CGT CDMO의 이해 ①]
바이럴 벡터 생산량 증대를 위한 공정

미국 텍사스에 있는 CGT CDMO 전문기업 마티카 바이오테크놀로지가 공개한 백서(White Paper)를 기반으로 세포∙유전자치료제의 CDMO의 구조와 기능을 알아보는 [CGT CDMO의 이해] 칼럼을 8편 연재합니다.
1편에서는 세포∙유전자치료제 개발에 가장 많이 활용되는 바이럴 벡터(Viral Vector) 제조 과정을 알아보겠습니다.
비정상 유전자를 정상 유전자로 대체시켜 유전적 결함을 치료하거나 새로운 기능을 추가하는 치료 분야가 빠르게 발전하고 있다.
유전자 치료 기술은 유전성 질환, 암, 전염병을 포함한 다양한 질병을 치료하는데 있어 가능성을 보였다. ‘기적의 항암제’, ‘꿈의 항암제’로 불리는 CAR-T(Chimeric Antigen Receptor-T, 키메라 항원수용체 T세포) 세포치료제와 유전성망막질환 유전자 치료제인 ‘럭스터나'(Luxturna)가 대표적이다. 이런 유전자 치료제를 개발하기 위해서는 넘어야 할 여러 장벽이 있지만 가장 중요한 것은 바이럴 벡터 제조 과정이다.
유전자 치료제는 체세포 유전자 치료제(Somatic Gene Therapy)와 생식세포 유전자 치료제(Germline Gene Therapy)로 나뉜다. 체세포 유전자 치료제는 투약 대상만이 치료와 예방 효과를 얻을 수 있다. 하지만, 생식세포 유전자 치료제는 투약을 통해 본인이 아닌, 다음 세대에서 유전자의 변형이 일어나기 때문에 위험성과 윤리적인 문제 때문에 아직까지 허용되지 않고 있다.
체세포 유전자 치료는 특정한 유전자 변이를 교정하기 위해 DNA 또는 RNA와 같은 치료 유전자를 환자에게 주입해 세포에 전달되도록 하는 방식이다. 치료 유전자가 세포의 핵 속으로 들어가야 하는데, 이 때 운반꾼 역할을 하는 전달체가 바로 ‘벡터’다. ‘벡터’는 비바이러스성 벡터와 바이러스성(바이럴) 벡터 두 가지로 나뉜다.
‘비바이러스성 벡터’는 세포에 바이러스가 유입되지 않으며, 숙주에 대한 면역반응도 낮아 부작용이 적다. 특히 주입하는 유전자의 크기에 제한이 없고, 대량 생산이 가능하다. 그러나 바이러스 벡터보다 세포 내 도달하는 효율성이 낮은 단점이 있다.
그래서 바이럴 벡터가 더 많이 사용된다. 바이럴 벡터는 바이러스 고유의 증식 기전을 이용한다. 아데노바이러스, 레트로바이러스, 아데노부속바이러스 등이 대표적이다. 치료용 유전자가 세포에 전달되는 효율이 높다.
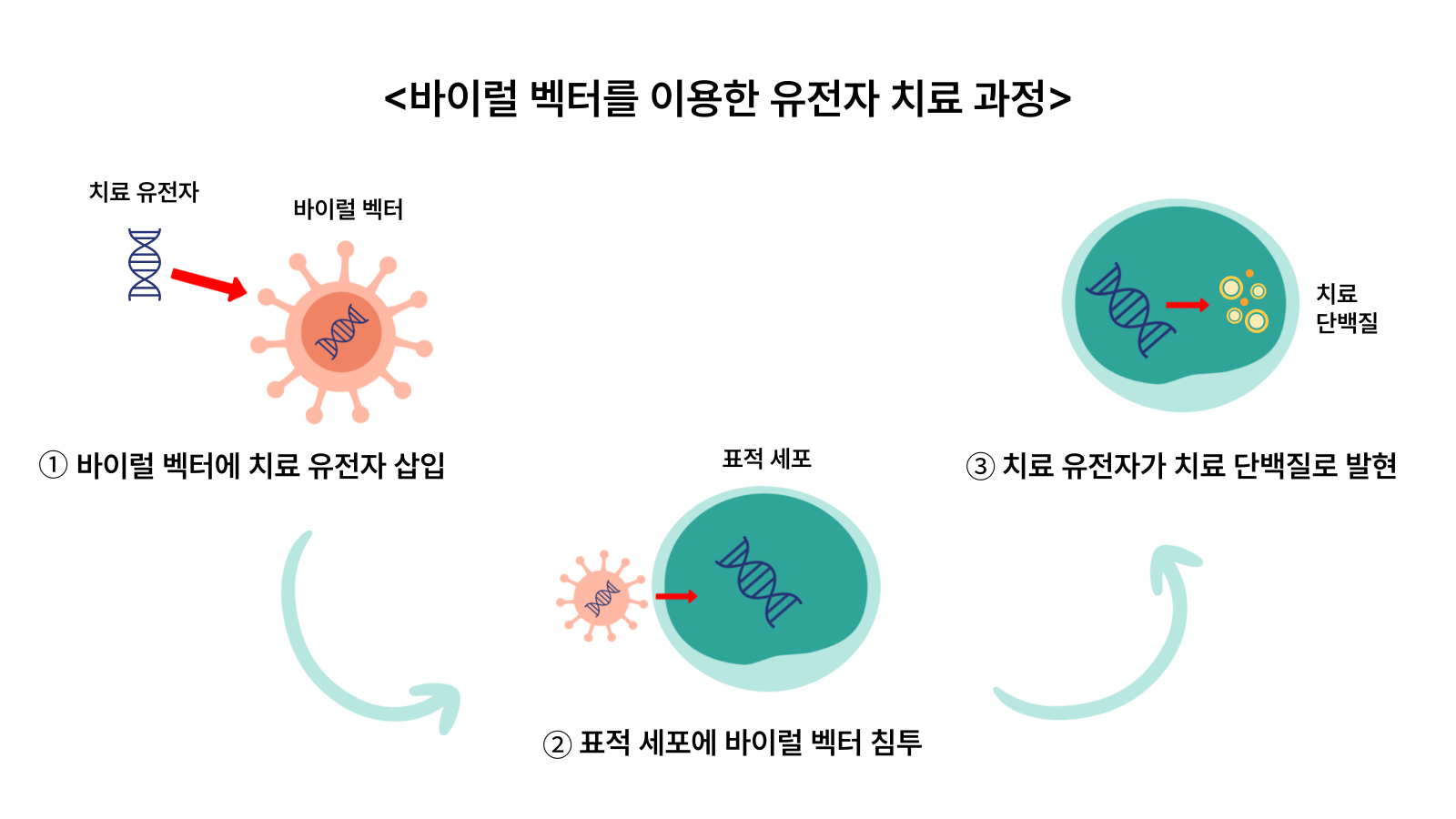
이번 백서에서는 유전자 치료제 개발에 매우 중요한 ‘바이럴 벡터 제조 과정’을 간략히 소개한다. 바이럴 벡터 제조에서 업스트림은 대량생산을 위해 체급을 늘리는 스케일 업 과정이다. 세포주 확보, 세포은행 구축, 세포 배양, 형질주입 등의 공정을 거친다.
1. 세포 은행(Cell Banking)
첫 단계는 바이러스 벡터 제조에 적합한 세포주를 확보해 세포 은행을 만드는 것이다. 인체 유래 세포주 HEK293과 곤충 세포주 Sf9가 대표적인 예다. 최적 조건에서 단일 배양해 얻은 균일한 세포 부유액을 여러 용기에 동일한 양으로 분주해 마스터 세포 은행(Master Cell Bank)를 구축한다. 세포의 생존률을 높이기 위해 동결방지제(Cryoprotectants)을 추가해 냉동 보관한다.
2. 세포 배양(Seed stocking)
마스터 세포 은행을 기반으로 일정한 계대수로 늘리기 위해 추가 배양한 제조용 세포 은행 (Working Cell Bank)을 만드는 과정이다. 세포를 성장시키고 살아있는 세포를 가능한 한 많이 확보하기 위해 온도, CO2 농도, 영양소 공급량을 지속적으로 조절해 철저하게 통제된 조건을 유지한다.
3. 세포 확장(Cell expansion)
제조용 세포은행이 구축되면 형질주입에 필요한 세포를 생산한다. 세포 성장에 필요한 최적의 조건을 제공하도록 설계된 세포배양기(bioreactor)에서 많게는 2000리터의 세포를 배양한다. 세포배양기는 ▲수소이온농도지수(pH) ▲용존산소(DO) 및 이산화탄소(CO₂) 농도 ▲온도 등을 모니터링하고 조정하는 센서와 제어시스템을 갖추고 있다.
부착형(Adherent)과 부유형(Suspension) 세포 플랫폼과 마이크로캐리어 시스템(Microcarrier Hybrid system) 등과 같은 배양 방식을 선택할 수 있다. 이는 다음 단계인 형질주입에 필요한 충분한 양의 세포를 배양하는 것이 목적이다.

4. 형질주입(Transfection)
바이럴 벡터를 생산에서 중요한 공정 중 하나가 형질주입(Transfection)이다. 생산하고자 하는 바이러스 유전물질을 숙주세포(Host Cell)에 삽입하는 과정이다. 바이럴 벡터의 종류, 표적세포의 종류, 원하는 유전자 발현 수준 등에 따라 전기장을 가해 세포막의 투과성을 증가시키는 전기천공법(electroporation)이나 리포솜을 사용해 DNA를 도입하는 리포펙션(lipofection) 등 다양한 방법으로 형질주입을 한다.
여러가지 요인에 따라 형질주입의 효율은 10%부터 80%까지 다양하게 나타난다. 형질주입 단계에서 많은 양의 세포가 폐기된다.

5. 바이럴 벡터 생산(Viral Vector production)
성공적으로 형질주입이 된 후 유전물질을 포함한 세포가 지속적으로 분열하면서 바이러스를 생산하는 세포가 대량으로 생산된다. 이때 유전물질이 잘 삽입되고 세포가 빠르고 안정적으로 분열할수록 적은 양의 유전물질과 시약으로 동일한 양의 바이럴 벡터를 생산할 수 있고, 전체 공정에 소요되는 시간도 단축할 수 있다.
이때 가장 고려해야 할 것은 생산 규모다. 임상 단계나 규제기관 인·허가를 위한 소량 생산을 넘어 대규모 환자 치료에 사용하려면 대량 생산이 가능해야 한다.
바이럴 벡터의 생산 공정은 아직 정해진 공식이나 가이드라인이 확립되어 있지 않다. 따라서 균일한 품질의 바이럴 벡터를 생산하기 위해 실시간 공정데이터를 수집·분석할 수 있어야 하고, 고도의 기술력과 전문성을 가진 전문 인력이 필수적이다. #

CGT CDMO의 이해 칼럼 2편 이어보기
→ [CGT CDMO의 이해 ②] 바이럴 벡터 다운스트림 공정과 공정기술이전










