[DI 완전정복 ①]
의약품 개발 관련 모든 분야에 적용되는
‘데이터 완전성(Data Integrity)’

‘데이터 완전성(Data Integrity)’에 바이오·제약업계의 관심이 뜨겁다.
미국 식품의약국(FDA), 영국 의약품 및 보건의료제품규제청(MHRA)과 같은 해외 규제기관과 세계보건기구(WHO), 의약품상호실사협력기구(PIC/S)는 ‘데이터 완전성’에 대한 규정을 만들고 가이드라인을 발간했다.
바이오·제약 업계에서는 앞으로 ‘데이터 완전성’을 확보하지 못하면 의약품을 연구 개발하고 생산하는 것을 포기해야 한다는 말이 나올 정도다.
중요성이 강조되고 있는 ‘데이터 완전성’이 무엇이고, 어떤 특징을 갖고 있는지 살펴보자!
데이터 완전성이란?

데이터는 이론을 세우는데 기초가 되는 사실 또는 바탕이 되는 자료다. 우리는 관찰이나 실험, 조사에서 얻어낸 것을 연구노트, 워크시트(worksheet) 등 종이에 기록하기도 하고, 사진이나 다른 매체에 기록하기도 한다. 데이터는 결과물이 아니라 결과물을 뒷받침하는 근거다. ‘우리가 만들고자 하는 것이 무엇이냐?’에 따라 활용방안은 다양하다.
‘데이터 완전성(Data Integrity)’은 이런 데이터가 생성되고 폐기되는 전주기(Data Lifecycle)동안 데이터가 완전하고, 일관되고, 정확한지를 의미한다.
식약처 ‘첨단바이오의약품 데이터 완전성 안내서’는 “데이터는 완전(Complete)하고 일관(Consistent)되며 정확(Accurate)하여야 하고, 출처(Attributable)를 확인할 수 있으며, 판독(Legible)이 가능하고, 발생과 동시(Contemporaneous)에 기록된 원본(Original)이거나 사본을 말한다. 데이터가 우연하게 또는 의도적으로 변경·파괴되지 않도록 보존하고, 데이터의 특성이 데이터 전주기(Data Lifecycle) 동안 유지되어야 한다”고 명시하고 있다.
데이터 완전성의 5가지 원칙 ‘ALCOA’
수집, 처리 및 보고된 모든 데이터가 완전성을 갖추기 위해 시스템을 구축하고 실현해야 한다. 데이터는 ‘ALCOA’ 원칙을 따라야 한다.
‘ALCOA’라는 용어는 1990년대 초 FDA 조사관 출신의 스탠 울렌(Stan W. Woollen)이 실험실 관리기준(GLP, Good Laboratory Practice)을 주제로 한 발표에서 처음 사용했다.
▲기인성(Attributable) ▲가독성(Legible) ▲동시성(Contemporaneous) ▲원본성(Original ) ▲정확성(Accurate)을 뜻하는 영어단어 첫 글자를 딴 것이다.
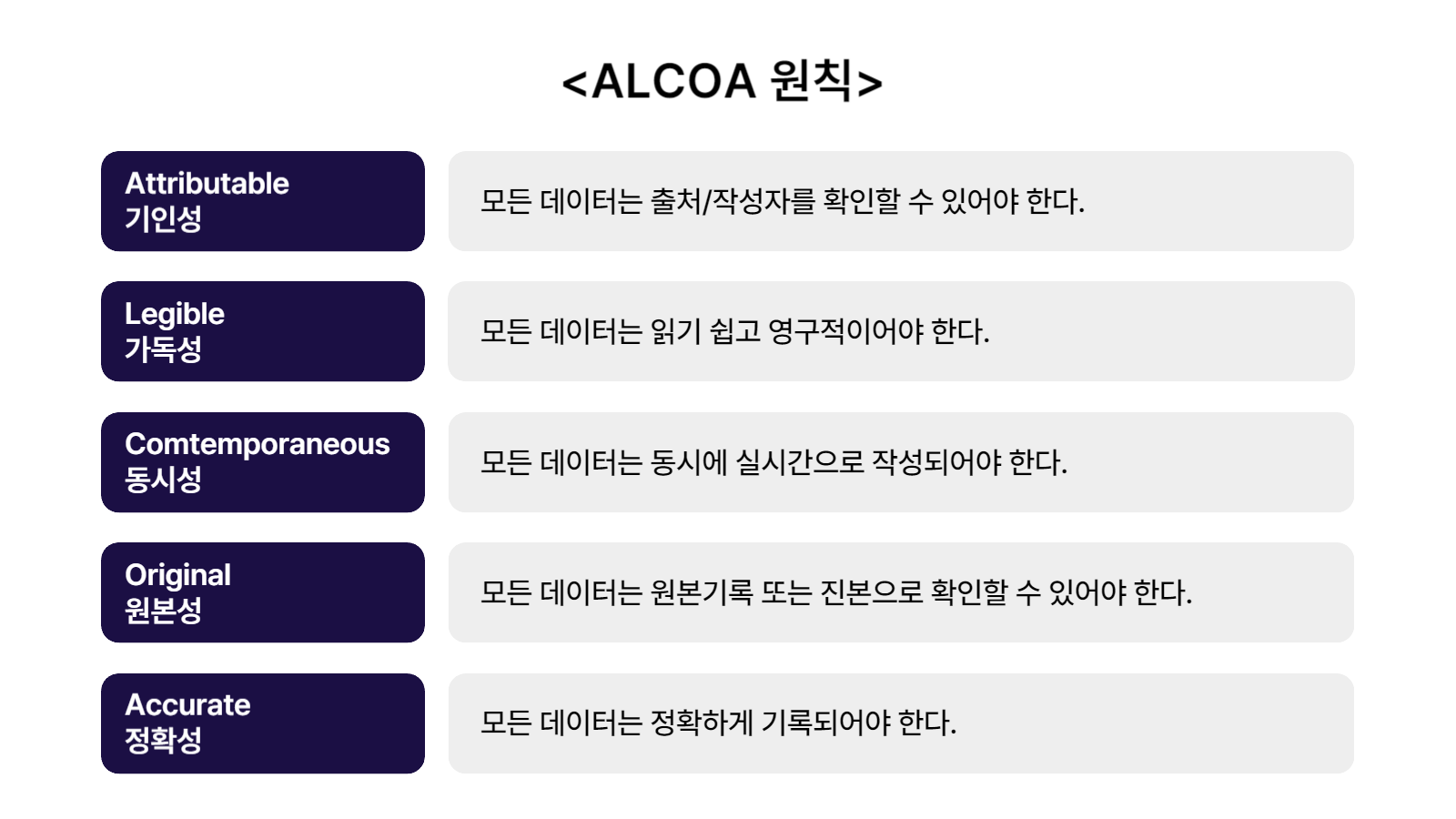
발표 이후에도 ‘ALCOA’라는 용어를 사용하면서 사람들에게 알려졌고, 많은 사람들이 사용하면서 데이터 완전성을 대표하는 단어가 되었다.
데이터 처리·저장·보관 원칙 추가한 ALCOA+

사람이 태어나서 성장하고 사망하듯이 데이터도 전주기(Data Lifecycle)라는 생애 주기가 있다. 데이터 전주기는 데이터가 생성되고 폐기 될 때까지의 기록(분석, 변환 및 이관을 포함), 처리, 수정, 전송, 검토, 보고, 사용, 승인, 유지, 검색, 보관 및 복구되는 프로세스의 모든 단계를 말한다.

데이터는 전주기 동안 완전성을 유지해야 하지만 단계마다 완전성을 위협하는 요소들이 있다. ALCOA는 데이터가 생성되어 사용하는데 완전성을 유지하는 중요한 기준이 되지만, 데이터의 처리, 저장, 보관을 위해서는 추가적인 원칙이 필요했다.
그래서 ALCOA에 ▲완전성(Complete) ▲일관성(Consistent) ▲지속성(Enduring) ▲가용성(Available)의 4가지 원칙을 추가해 ALCOA+라는 개념이 등장했다.
우리나라에서도 ‘데이터 완전성’에 대한 인식이 높아져 식품의약품안전처(이하, 식약처)가활발하게 움직이고 있다. 식약처는 2020년 7월 의약품 품질 신뢰성 보증 체계를 강화하기 위해 의약품 제조 및 품질관리(GMP)에 대한 ‘데이터 완전성 평가 지침’을 마련해 업계에 배포했다. GMP를 점검할 때 ‘데이터 완전성 평가기준’을 중점적으로 살펴보겠다고 예고했다. 평가 대상도 2020년 보툴리눔 독소제제를 시작으로 2023년에는 전체 바이오의약품으로 확대했다. 2023년 1월에는 ‘첨단바이오의약품 데이터 완전성 안내서’를 발간했고, 첨단바이오의약품 제조업체도 데이터 완전성 평가 지침을 이행해야 한다고 밝혔다.
이번 칼럼에서는 데이터 완전성이 무엇인지, 어떤 특징을 갖고 있는지, 식약처에서는 어떻게 정의하고, 어떤 활동을 펼치고 있는지 살펴봤다. ‘데이터 완전성’은 임상시험관리기준(GCP), 실험실 관리기준(GLP) 등 데이터의 정확성을 확보해야 하는 의약품 개발 관련 모든 분야에 적용된다. 그 중요성은 아무리 강조해도 지나치지 않다.
다음 칼럼에는 데이터 관리체계인 데이터 거버넌스(Data Governance)에 대해 설명하겠다. #

DI 완전정복 칼럼 2편 이어 보기
→ [DI 완전정복 ②] 데이터 관리를 위한 책임과 규칙 ‘데이터 거버넌스(Data Governance)’










