[DI 완전정복 ③]
의약품 개발 단계에서
‘데이터 완전성(Data Integrity)’의 중요성

이전 칼럼에서 데이터 완전성이 무엇이고 어떤 특징이 있는지, 데이터 완전성을 확보하려면 어떻게 해야 하는지 살펴봤다.
데이터 완전성은 의약품을 개발하고 생산하는 과정에서 문제가 발생했는지를 확인하는 지표다. 데이터 완전성을 확보하지 못하면 10년 이상 쌓아온 연구∙개발 성과가 물거품이 될 수 있다. 데이터 완전성의 중요성은 아무리 강조해도 지나치지 않다.
이번에는 의약품 인허가 과정에서 데이터 완전성을 확보하지 못하면 어떤 일이 생기는지 알아보자.
임상시험계획 승인 취소, 제조업무 정지 등 행정처분
의약품을 개발, 판매하기 위해서는 적법한 절차를 거쳐야 한다. 먼저 식품의약품안전처(이하 식약처)에 임상시험계획을 승인 받아야 한다. 식약처가 승인하면 임상시험을 통해 의약품의 안전성과 효능을 입증해야 한다.
임상시험이 끝나면 안전성, 유효성, 품질에 관한 입증자료를 식약처에 제출하고, 의약품 시판 허가를 신청한다. 식약처는 이 자료를 심사해 적합하다고 판단되면 판매를 허가한다.
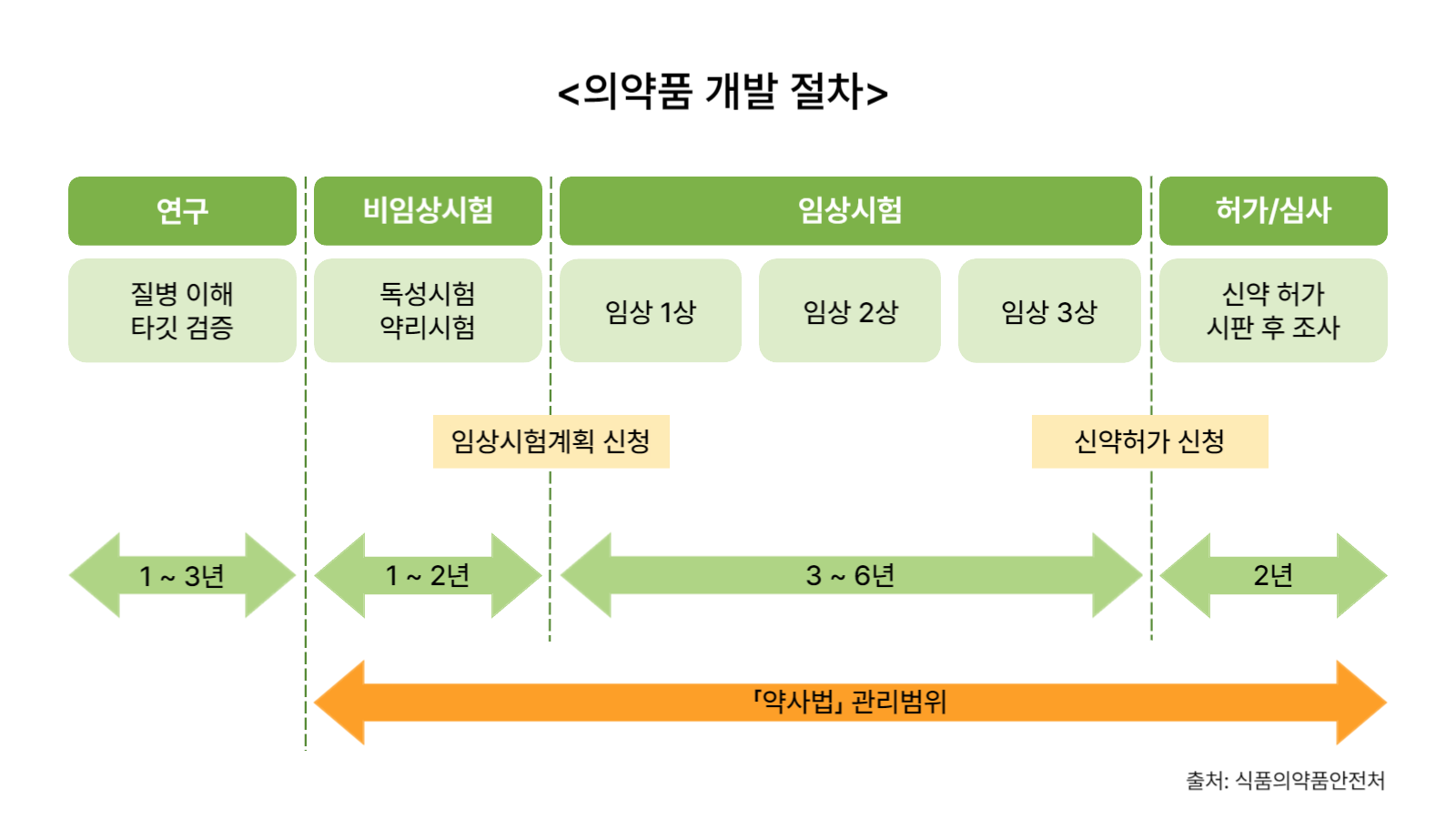
임상부터 시판까지 일련의 과정에서 기업이 데이터 완전성을 확보하지 못했다면, 식약처는 임상시험계획 승인을 거부하거나, 의약품의 판매를 허가하지 않는다. 또 식약처가 시판 후 조사를 통해 의약품 제조 과정에서 거짓이나 오류를 발견하면 제조업무정지 등의 행정처분을 내릴 수 있다.
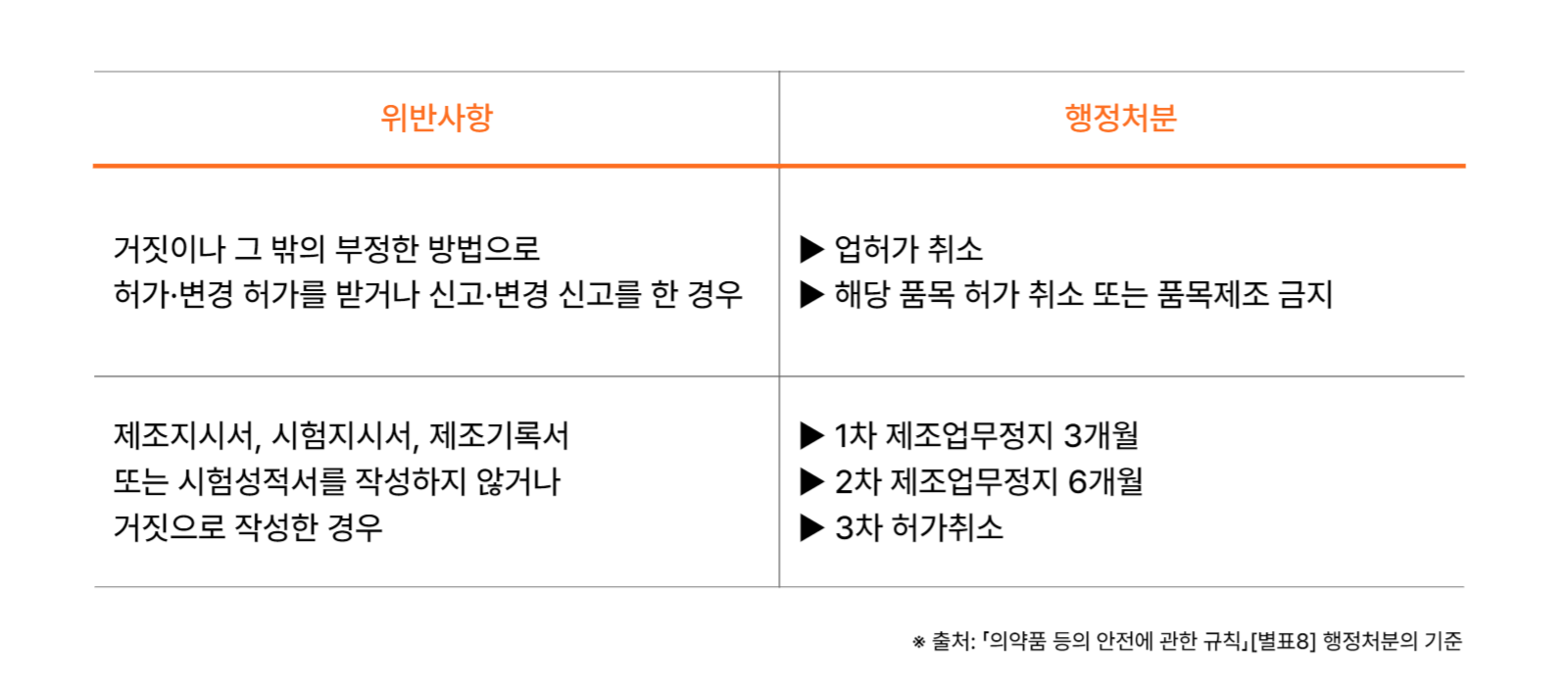
식약처는 2020년 3월, 약사법을 개정해 ‘거짓이나 부정한 방법으로 허가를 받은 경우’에 허가를 취소하고 벌칙을 부과하는 근거를 마련했다. 이미 승인한 임상시험이라도 관련 서류와 기록에서 거짓이나 부정이 발견되면 취소 처분을 내린다. 이는 규제기관이 데이터 완전성의 중요성을 인식하고 있다는 근거다.
국내 품목 허가취소 및 GMP 적합판정서 취소
데이터 완전성을 확보하지 못해 품목허가가 취소되거나, 허가 사항과 다르게 의약품을 제조해 의약품 제조∙품질관리기준(GMP) 적합 판정이 취소된 사례를 살펴보자.
A사는 품목허가를 받기 위해 식약처에 제출한 자료를 허위로 작성했다가 적발돼 폼목 허가가 취소됐다. 잔류용매 시험 결과가 기준을 초과했는데도 기준 내 수치를 허위로 작성했다. (「약사법」제76조제1항제2호의3 위반)
B사는 안정성 시험자료를 조작했다가 적발됐다. 시험에서 안정성을 확보하지 못했음에도 확보한 것으로 거짓 작성했는데, 이로 인해 품목허가가 취소됐다. 안정성 시험자료는 임상시험계획서와 품목허가 사항 중 사용(유효)기간을 설정하는데 중요한 자료다. (「약사법」제76조제1항제2호의3 위반)
C사는 지속적, 반복적으로 허가사항과 다르게 첨가제를 임의적으로 증·감량해 의약품을 제조했다. 제조기록서에는 허가사항과 동일하게 제조하는 것처럼 거짓 작성한 사실이 적발됐다. C사는 의약품 제조∙품질관리기준(GMP) 적합판정 취소 처분을 받았다. 자체 GMP시설에서 의약품을 제조할 수 없을 뿐만 아니라 다른 제약사가 위탁한 의약품도 생산하지 못한다.
미국 FDA, 경고장(Warning Letter) 발부
미국 식품의약국(이하 FDA)은 미국의 식품이나 의약품과 관련된 규정을 시행∙점검하고 제품∙기기 허가를 승인하는 규제기관이다. 우리나라에서 개발∙제조한 제품을 미국에 수출하기 위해서는 FDA 승인을 받아야 한다.
승인 과정에서 FDA는 제조시설을 현장실사 한다. 그 결과 문제가 심각해 FDA의 직접 개입이 필요한 경우에는 OAI(Official Action Indicated; 부적격 등급)가 매겨진다. FDA가 OAI를 기재하면 해당 기업에는 경고장(Warning Lette)이 발부된다. 경고장을 받은 업체는 15일 안에 시정 내용을 담은 문서를 FDA에 보내야 한다. 이후 경고장에 언급된 위반사항이 시정되면 FDA는 해당 기업에 종료서한(Close Out Letter)을 보낸다.

D사와 E사가 받은 경고장(Warning Letter) 내용 중 일부분이다.
임상시험과 관련된 사항에서 데이터 완전성을 확보하지 못해 받은 경고다. 임상시험이 정해진 기준에서 벗어난 상태에서 시행됐거나, 임상시험 데이터가 누락되어 임상시험 결과에 신뢰성이 떨어진 경우에 해당된다.

F사는 전산 장비에 저장되어 있는 데이터를 주기적으로 백업하지 않았고, 3개월이 지나면 자동적으로 삭제되도록 했다. 이로 인해 데이터 완전성을 확보하지 못했고 위와 같은 경고 서한을 받았다.
연구 데이터 = ‘데이터 완전성(Data Integrity) = 신뢰
이번 칼럼에서는 우리나라 식약처나 미국 FDA와 같은 규제기관에서 데이터 완전성을 확보하지 못한 기업들에게 어떤 조치를 하는지 살펴봤다.
데이터 완전성의 중요성을 다시 한 번 강조하며, 3회에 걸쳐 연재한 칼럼을 마무리하고자 한다. 허가 취소나 벌칙을 받는 것도 피해야 하지만, 의약품을 개발하고 생산하면서 데이터 신뢰성을 확보하지 못하면 장기간의 연구개발 노력이 물거품이 될 수 있다는 점을 명심해야 한다.
연구 데이터와 결과물을 체계적으로 관리해 데이터 완전성을 확보해야만 연구개발을 지속할 수 있고, 더 나아가 기술이전이나 상업화가 가능하다는 것을 잊지 말아야 한다. #

DI 완전정복 칼럼 2편 다시 보기
→ [DI 완전정복 ②] 데이터 관리를 위한 책임과 규칙 ‘데이터 거버넌스(Data Governance)’










